イオン
このページは、中学3年理科で学習するイオンに関して、計算を含む問題のプリントを収録しています。類題を含む多数のプリントの中から、必要な内容のプリントを簡単に表示し、必要なだけダウンロードすることができます。

はじめに
この単元では、中学2年の化学反応に続く内容で、イオンが関係する化学反応に関する内容を学習します。化学式・イオン式・電離式など覚えなければならない内容が多い一方で、単に反応式を覚えるだけでは答えられないような問題も出題されます。しかし、出題パターンはそれほど多くないので、理解できれば得点を期待できる範囲でもあります。
図を使った問題などちょっと面倒でしたが、いまのところ利用できるレベルにはなったと思っています。各プリントで答えは表示していますが、途中経過は示していません。必要に応じて、このページの内容を参照してください。
なお、ここで公開しているプリントもGoogleのスプレッドシートを利用して作成しています。

計算問題のプリント
算数・数学の計算問題の無料プリントを公開しています。予習・復習・定期テスト対策・受験対策のためなどに幅広くご利用いただけます。
これらのプリントの利用により何らかの不利益が生じた場合でも、当方は責任をとりません。利用規約にご同意の上、ご自由にご利用下さい。誤字・脱字や、間違いを発見された場合は、管理者(dsktcy.kkzn.junj@gmail.com)までご連絡いただけるとありがたいです。

pdfプリント利用規約
問題の解き方とプリント
プリントは以下の4種類があります。
| ① イオンの生成 |
| ② 電離式 |
| ③ 中和(1) |
| ④ 中和(2) |
プリントの種類と解き方
原子からイオンが生成するときの電子の出入りを答えます。以下、電子をe-とします。
例
- 陽イオンの場合
-
原子から陽イオンが生じるには、原子から電子が抜ける必要があります。
Cu → Cu2+ + 2e- - 陰イオンの場合
-
原子から陰イオンが生じるには、原子に電子が付加される必要があります。
Cl + e- → Cl-
抜かれたり、付加されたりする電子の数は、生成するイオンの価数(+または-の数)によります。「→」の左右で、合計電荷は同じになります。
- 例題1
-
以下の原子がイオンになる様子を化学式を使って表しなさい。
①ナトリウム原子 → ナトリウムイオン
②硫黄原子 → 硫化物イオン - 解答
-
① Na → Na+ + e-
② S + 2e- → S2-
ある化合物を水に溶かしたとき、その水溶液が電気を通す場合、その化合物のことを電解質といいます。また、電解質が水に溶けたときに、陽イオンと陰イオンに分かれることを電離といいます。電解質が陽イオンと陰イオンに分かれるようすを化学式で表したものが電離式です。
例
- 塩化ナトリウム
-
塩化ナトリウムは、ナトリウムイオンと塩化物イオンに電離します。
NaCl → Na+ + Cl- - 硫酸
-
硫酸は、水素イオンと硫酸イオンに電離します。1個の硫酸分子の電離で、2個の水素イオンと、1個の硫酸イオンが生成します。
H2SO4 → 2H+ + SO42-
「→」の左側は分子なので合計電荷が0になります。したがって、「→」の右側の合計電荷も0になります。
- 例題2
-
以下の化合物の電離式を答えなさい。
①塩化水素
②水酸化カルシウム - 解答
-
①HCl → H+ + Cl-
②Ba(OH)2 → Ba2+ + 2OH-
中和とは、酸に含まれる水素イオン(H+)とアルカリに含まれる水酸化物イオン(OH-)が化合して水を生成する反応のことです。
H+ + OH- → H2O酸とアルカリの水溶液を混ぜる割合が変わると、混ぜた水溶液の性質(酸性・中性・アルカリ性)が変わります。
- 例題3
-
うすい塩酸300mLに緑色のBTB溶液を数滴加えたビーカーを5つ(A~E)用意した。表は、それぞれのビーカーに示された量のうすい水酸化ナトリウム水溶液を加えてよく混ぜた後の液体の色を表したものである。以下の問いに答えなさい。
A B C D E 水酸化ナトリウム水溶液 (mL) 0 30 60 90 120 溶液の色 黄 黄 黄 緑 青
(1) 中性の水溶液はA~Eのどれか。
(2) うすい塩酸600mLを中和するのに必要なうすい水酸化ナトリウム水溶液は何mLか。
(3) 水溶液Eを完全に中和するためには、ア、イどちらの水溶液を何mL加えればよいか。
ア.うすい塩酸
イ.うすい水酸化ナトリウム水溶液 - 解き方
-
(1) 水溶液が中性のとき、BTB溶液は緑色になる
水溶液D
(2) うすい塩酸300mLを中和するのにうすい水酸化ナトリウム90mLが必要
うすい塩酸600mLを中和するのに必要なうすい水酸化ナトリウム水溶液を x mLとすると、
300(mL) : 90(mL) = 600(mL) : x(mL)
x = 180 (mL)
180 mL
(3) 中性になった水溶液Dよりも水酸化ナトリウム水溶液を30mL多く加えている
この水酸化ナトリウム水溶液を30mL分を中和する必要があります
これを中和するのに必要なうすい塩酸を y mLとすると
(2)と同様に、
300(mL) : 90(mL) = y(mL) : 30(mL)
y = 100 (mL)
ア. 100 mL
中和の様子を図で表す問題はよく出題されます。混ぜる酸・アルカリが1価(HCl、NaOHなど)なのか2価(H2SO4、Ca(OH)2など)なのかによって、様子が変わります。
- 例題4
-
うすい水酸化ナトリウム水溶液を使ってうすい塩酸を中和します。以下の各問いに答えなさい。
(1) この中和反応の化学反応式を答えなさい。
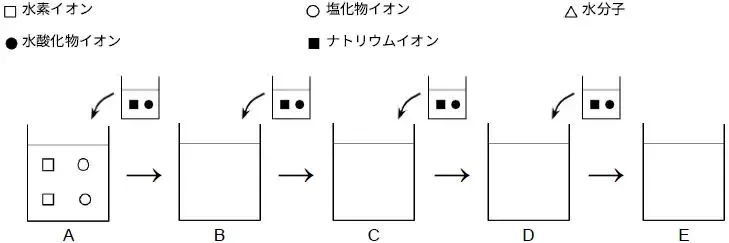
(2) この中和反応を以下のような図で表したい。B~Eにあてはまる適切な図を描きなさい。
(3) 水溶液A~Eの性質は、それぞれ酸性・中性・アルカリ性のどれか。
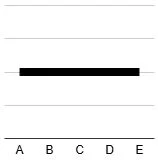
(4) ①水素イオン、②水酸化物イオン、③ナトリウムイオン、④塩化物イオンの数の変化をグラフで著したグラフをそれぞれア~エから選べ。ア イ ウ エ 


- 解き方
-
(1)
HCl + NaOH → H2O + NaCl
(2) 以下の反応により、1個の水素イオンと1個の水酸化イオンは中和されて水分子1個になります
H+ + OH- → H2O
一方で、ナトリウムイオンと塩化物イオンは濃度が高くならなければ、電離したままです
解答は以下の図
B C D E 



(3) 水溶液中に水素イオンがあれば酸性、水酸化物イオンがあればアルカリ性、どちらもなければ中性になります
A:酸性、B:酸性、C:中性、D:アルカリ性、E:アルカリ性
(4) (2)の図からそれぞれのイオンの数を数えます
①エ ②イ ③ア ④ウイオン A B C D E H+ 2 1 0 0 0 OH- 0 0 0 1 2 Na+ 0 1 2 3 4 Cl- 2 2 2 2 2
プリント
問題の種類を選択して「更新」ボタンを押すと、pdfプリントへのリンクが更新されます。再度「更新」ボタンを押すと、問題が変わります。プリントを表示したい場合は、「pdfプリントの表示」をチェックして下さい。